





《人教版高二化学选修4《弱电解质的电离》PPT课件(第1课时)》是由用户上传到老师板报网,本为文库资料,大小为359.1 KB,总共有25页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 25页
- 359.1 KB
- VIP模板
- pptx
- 数字产品不支持退货
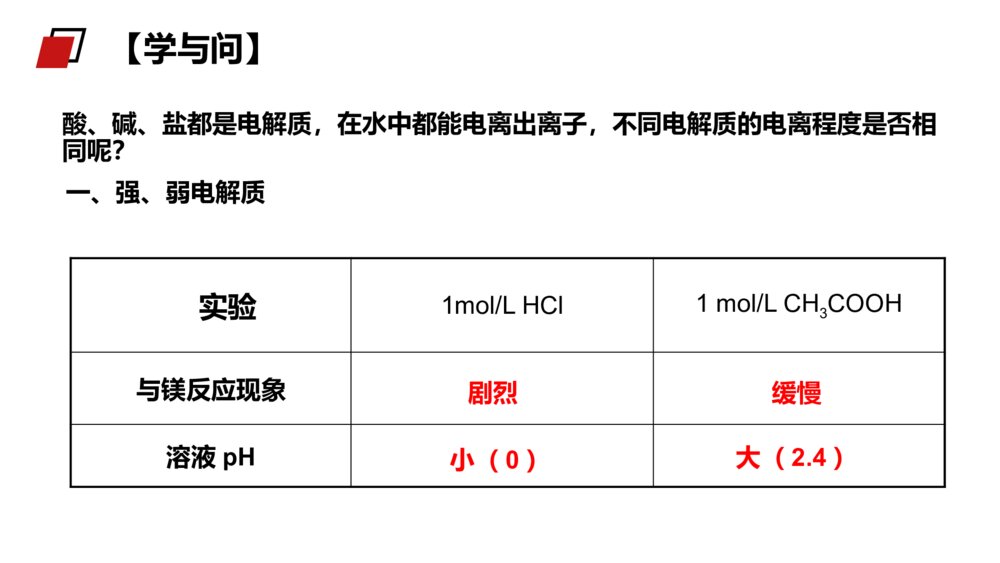
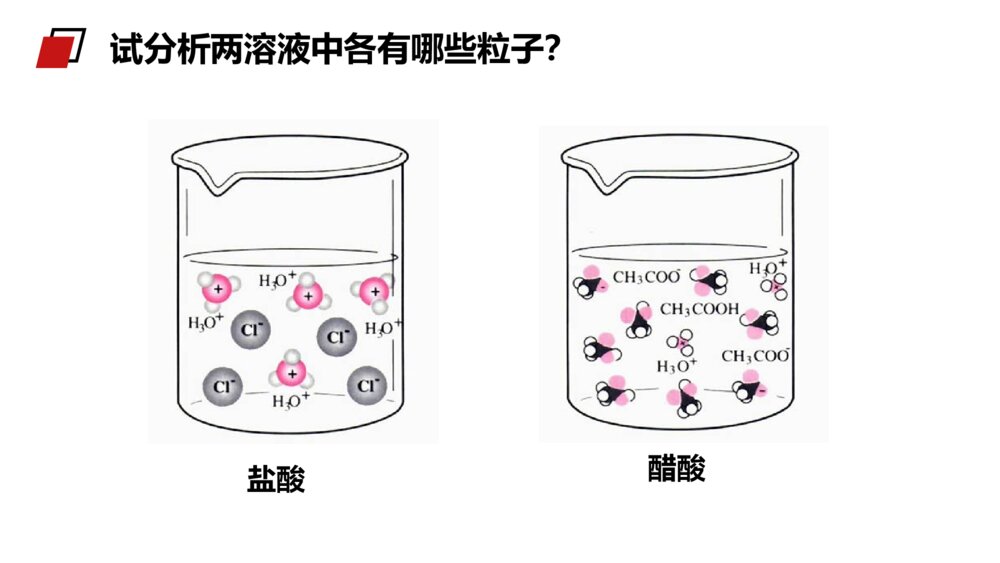
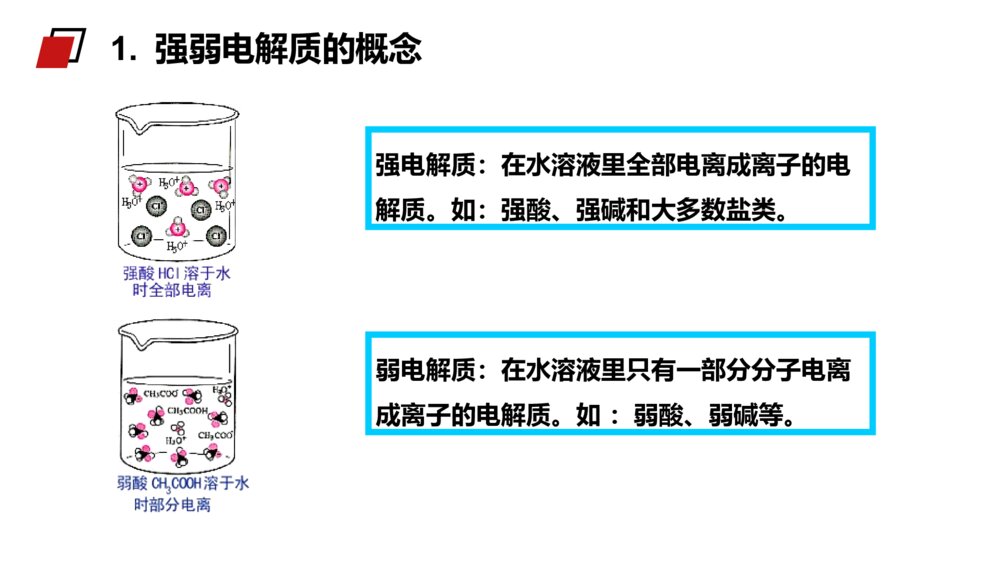
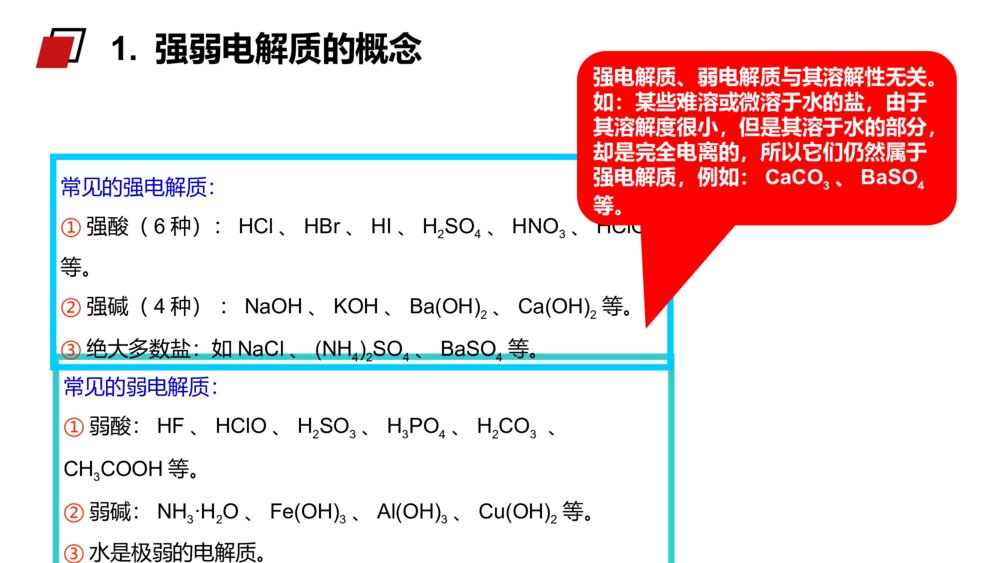
第1课时弱电解质的电离MENTALHEALTHCOUNSELINGPPT第一节弱电解质的电离第三章水溶液中的离子平衡人教版高中化学选修4(高二)学习目标1、认识强电解质和弱电解质的概念。2、理解电解质的电离平衡概念,加深对动态平衡的认识。3、理解导电性强弱与电解质强弱的关系。电解质:在水溶液中或熔融状态时能够导电的化合物。非电解质:在水溶液中和熔融状态都不能导电的化合物。酸、碱、盐、活泼金属氧化物。非金属氧化物、大多数有机物。知识回顾1.融化状态下不能导电的物质一定不是电解质2.溶于水能导电的物质一定是电解质3.某些化合物溶于水能导电一定是电解质4.某些化合物溶于水能导电一定是电解质练习巩固11.单质/混合物既不是电解质也不是非电解质。2.CO2、NH3等溶于水得到的水溶液能导电,但它们不是电解质,因为导电的物质不是其本身。3.难溶的盐(BaSO4等)虽然水溶液不能导电,但是在融化时能导电,也是电解质。4.电解质的导电:导电的条件是溶于水或熔融状态导电的本质是自由离子的定向移动导电能力与离子浓度和离子所带电荷有关注意:酸、碱、盐都是电解质,在水中都能电离出离子,不同电解质的电离程度是否相同呢?一、强、弱电解质实验1mol/LHCl1mol/LCH3COOH与镁反应现象溶液pH剧烈缓慢小(0)大(2.4)【学与问】实验现象不同,说明c(H+)不同。盐酸与镁反应剧烈、pH值小,说明盐酸中c(H+)大,HCl完全电离而醋酸只是部分发生电离。探究盐酸醋酸试分析两溶液中各有哪些粒子?强电解质:在水溶液里全部电离成离子的电解质。如:强酸、强碱和大多数盐类。弱电解质:在水溶液里只有一部分分子电离成离子的电解质。如:弱酸、弱碱等。1.强弱电解质的概念常见的弱电解质:①弱酸:HF、HClO、H2SO3、H3PO4、H2CO3、CH3COOH等。②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等。③水是极弱的电解质。常见的强电解质:①强酸(6种):HCl、HBr、HI、H2SO4、HNO3、HClO4等。②强碱(4种):NaOH、KOH、Ba(OH)2、Ca(OH)2等。③绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等。强电解质、弱电解质与其溶解性无关。如:某些难溶或微溶于水的盐,由于其溶解度很小,但是其溶于水的部分,却是完全电离的,所以它们仍然属于强电解质,例如:CaCO3、BaSO4等。1.强弱电解质的概念5.下列物质:属于强电解质的是______;属于弱电解质的是______;属于非电解质的是_____。a.铜丝b.金刚石c.石墨d.NaCle.盐酸f.蔗糖g.CO2h.Na2Oi.硬脂酸j.醋酸k.碳酸l.碳酸氢铵m.氢氧化铝n.氯气o.BaSO4d.h.l.oi.j.k.mf.g练习巩固27.可以证明醋酸是弱电解质的是()A、0.1mol/L的醋酸溶液pH约为2B、醋酸能与水以任意比互溶C、溶液的导电能力比盐酸弱D、溶液中存在醋酸分子BD练习巩固2分析与讨论:(1)NaCl、NaOH是由什么键构成的什么化合物?在水溶液里电解质以什么形式存在?(2)HCl、H2SO4是由什么键构成的什么化合物?(3)在水溶液里电解质以什么形式存在?2、强弱电解质与结构的关系(如强碱和大部分盐类)NaCl==Na++Cl-电离方程式可表示为:某些具有极性键的共价化合物}强电解质试写出Na2SO4、NaOH、H2SO4、KHSO4、Ba(OH)2在水溶液里的电离方程式.离子化合物CH3COOH、NH3·H2O是由什么键构成的什么化合物?在水溶液里电解质以什么形式存在?某些具有极性键的共价化合物(如弱酸、弱碱和水)弱电解质CH3COOHCH3COO-+H+写出HF、NH3·H2O、Fe(OH)3、H2CO3在水溶液中的电离方程式.分析讨论:离子化合物大部分的盐类强酸、强碱共价化合物弱酸弱碱水弱电解质强电解质离子型氧化物电解质非电解质多数有机物某些非金属氧化物化合物小结——完全电离,书写时用“=”号(2)弱电解质练习:写出下列电解质电离的方程式:CH3COOH、H2S、Cu(OH)2、CH3COONH4、K2CO3、KHCO3、KHSO4、——部分电离,书时用“”号小结电离方程式:强等号、弱可逆;多元弱酸分步写;多元弱碱一步完(1)强电解质2、电解质的电离方程式书写CH3COOH H++CH3COO-H++CH3COO- CH3COOH所以,实际上在醋酸的水溶液中存在下面的可逆过程:CH3COOH H++CH3COO-为什么醋酸溶于水时只有部分分子电离成H+和CH3COO-呢?2、电解质的电离方程式书写1、电离平衡:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。CH3COOHCH3COO-+H+电离结合1、开始时,V电离和V结合怎样变化?2、当V电离=V结合时,可逆过程达到一种什么样的状态?二、弱电解质的电离平衡弱电解质电离的V-t图像V电离V结合0t1t2V电离=V结合电离平衡状态tV二、弱电解质的电离平衡特点动电离平衡是一种动态平衡定条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子变条件改变时,电离平衡发生移动等V电离=V结合=0逆弱电解质的电离是一个可逆过程二、弱电解质的电离平衡(1)与化学平衡一样,电离平衡也是动态平衡。(2)化学平衡原理也适用于电离平衡,当浓度等条件改变时,弱电解质的电离平衡也会发生移动。写出H2CO3H++HCO3-平衡常数的表达式323()()()cHcHCOKacHCO定义:在一定条件下,弱电解质的电离达到平衡时,溶液中电离出来的各种离子浓度的乘积跟溶液中未电离的分子浓度之比值是个常数,这个常数称为电离平衡常数,简称电离常数。表达式:2、弱电解质相对强弱比较—电离常数CD例1下列叙述中,不正确的是()A、在熔化和溶解时均不导电的化合物,叫做非电解质B、电解质、非电解质都是指化合物而言,单质不在此范畴C、在水导电的物质一定是电解质D、水是极弱的电解质例2下列说法正确的是()A、氯水能导电,所以氯气是电解质B、碳酸钙不溶于水,所以它是非电解质C、固体磷酸是电解质,所以磷酸在熔化状态下和溶于水时都能导电课堂练习:B例3下列电离方程式正确的是()A.NaHCO3=Na++H++CO32-B.HCO3-H++CO32-C.KClO3=KCl-+3O2-D.NaOHNa++OH-例4在氨水中,NH3·H2O的电离达到平衡的标志是()A.溶液显电中性B.溶液中无NH3·H2O分子C.氢氧根离子浓度恒定不变D.溶液中NH3·H2O与NH4+和OH-共存C课堂练习:第1课时弱电解质的电离MENTALHEALTHCOUNSELINGPPT感谢各位的仔细聆听第三章水溶液中的离子平衡人教版高中化学选修4(高二)



















